Valoración Ácido base
¿Qué son ácidos y bases?
En química se llaman ácidos y bases a dos tipos diferentes de sustancias opuestas entre sí. Cada una de estas sustancias reúne propiedades específicas que modifican el comportamiento de las soluciones químicas. Tanto ácidos como bases pueden encontrarse en estado líquido, gaseoso y sólido (el polvo).
Al juntarse ácidos y bases en una solución, se produce una reacción exotérmica, es decir, se produce calor. Esta reacción se conoce como neutralización.
¿Qué es un ácido?
Se llaman ácidos a aquellas sustancias que liberan iones de hidrógeno positivos (H+) en una solución. Esta definición fue introducida por el científico Svante Arrhenius.
Otro concepto, desarrollado por el científico Gilbert Newton Lewis, define los ácidos como sustancias que pueden recibir o absorber un par de electrones de la solución.
Como ejemplos de ácidos podemos mencionar los siguientes:
- Ácido acético o CH3COOH (vinagre);
- ácido ascórbico o C6H8O6 (vitamina C);
- ácido fosfórico o H3PO4 (presente en las bebidas gaseosas);
- ácido láctico o C3H6O3 (producido durante el ejercicio físico);
- ácido cítrico o C6H8O7 (naranjas, toronjas, limones, mandarinas, etc.).
Características de los ácidos
Entre las características o propiedades de los ácidos podemos mencionar las siguientes:
- Tienen capacidad para destruir tejidos orgánicos.
- Producen reacciones al interactuar con ciertos metales.
- Actúan como conductores de corriente eléctrica.
- Al mezclarse con bases producen agua y sal.
- Son agrios al gusto.
- El pH de los ácidos oscila entre 0 y 7 (donde 7 es neutro).
- Suelen ser solubles al agua.
Tipos de ácidos
- Ácido fuerte: es aquel que se cede la mayor parte de sus iones de hidrógeno en solución, lo que quiere decir que se ioniza con gran facilidad. Por ejemplo, el HCl o ácido clorhídrico.
- Ácido débil: al contrario del anterior, el ácido débil en solución acuosa libera iones H+ en menor proporción. Por ejemplo, el ácido acético.
¿Qué es una base?
De acuerdo a Svante Arrhenius, se llaman bases a aquellas sustancias que pueden captar iones de hidrógeno en solución o liberan iones negativos, llamados hidroxilos (OH-).
También se definen las bases como aquellas sustancias que aportan dos electrones a la solución, siguiendo la teoría de Gilbert Newton Lewis.
Como ejemplo de bases, podemos mencionar los siguientes:
- Hidróxido de sodio o NaOH (soda cáustica);
- hidróxido de potasio o KOH (jabón);
- hidróxido de aluminio o Al(OH)3 (antiácido estomacal);
- hidróxido de magnesio o Mg(OH)2 (leche de magnesia);
- hidróxido de calcio o CaOH (cal).
Características de las bases
Entre las características o propiedades de las bases podemos mencionar:
- Deslizan al tacto cuando se presentan en disolución, es decir, son jabonosos (como la lejía).
- No reaccionan ante el contacto con metales.
- Son conductores de corriente eléctrica en disolución.
- Al mezclarse con ácidos producen agua y sal.
- Son amargos al gusto.
- El pH de las bases oscila entre 7 y 14 (donde 7 es neutro).
- Algunas bases son insolubles.
Tipos de bases
En el ámbito de las bases, se conocen al menos dos tipos elementales:
- Base fuerte: se refiere a una variedad de electrolito al que se le atribuye un carácter fuerte y que, por lo tanto, puede ionizarse totalmente en una solución acuosa. Por ejemplo, la soda cáustica.
- Base débil: se refiere a aquellas bases que no se disocian totalmente en la solución acuosa, de lo que resulta la presencia de un ion OH más el radical básico. Por ejemplo, el amoníaco o hidróxido de amonio.
Diferencia entre ácidos y bases
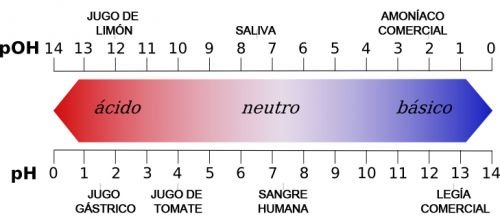
Una de las diferencias más importantes entre ácidos y bases es que los ácidos captan electrones de la solución en la que están disueltos, mientras que las bases los aportan. Asimismo, los ácidos liberan iones positivos de hidrógeno, mientras que las bases liberan hidroxilos.
Debido a estas diferencias, ácidos y bases producen efectos diversos en las soluciones químicas. Por ejemplo, en las pruebas de pH se acostumbra usar papel tornasolado. El papel tornasolado azul adquiere tonalidades cálidas al contacto con ácidos, es decir, adquiere tonos rosas o rojos según la intensidad. Por el contrario, cuando una base reacciona con un papel tornasolado rojizo, este adquiere tonalidades azules.
Sistema buffer
Algunas veces es necesario preparar y guardar una solución con un pH constante. La preservación de dicha solución es aún más difícil que su preparación:
- si la solución entra en contacto con el aire, absorberá dióxido de carbono, CO2, y se volverá más ácida.
- si la solución se guarda en un recipiente de vidrio, las impurezas alcalinas "desprendidas" del vidrio pueden alterar el pH.
Las soluciones buffer o amortiguadoras son capaces de mantener su pH en valores aproximadamente constantes, aún cuando se agreguen pequeñas cantidades de ácido o base, o se diluya la solución.
Una disolución buffer o amortiguadora se caracteriza por contener simultáneamente una especie débil y su par conjugado:
- un ácido débil y la sal de su par conjugado
- una base débil y la sal de su par conjugado
B + H2O BH+ + OH–
La disolución buffer debe contener una concentración relativamente grande de cada uno de los integrantes del par conjugado, de modo que:
- la especie ácida del sistema buffer pueda reaccionar con los iones OH– que se le añadan
- la especie básica del sistema buffer pueda reaccionar con la cantidad de iones H+ que se añadan
La presencia del par conjugado hace que la especie débil se disocie en menor proporción: | |
HA + H2O | B + H2O |
La presencia de la especie débil hace que el par conjugado se hidrolice menos: | |
A– + H2O | BH+ + H2O |
|
Cómo calcular el pH en soluciones buffer
Creación y realización Thema Equipo Editorial S. A. (2002) Consultor Estudiantil "Mi Secundaria".
Lic. Marroquín Tinti M. N. Catedrática de la Universidad Galileo de Guatemala (2021), presentación "Química General"
"Ácidos y bases ". En: Significados.com. Disponible en: https://www.significados.com/acidos-y-bases/ Consultado: 8 de mayo de 2021



No hay comentarios.:
Publicar un comentario