Estequiometria
¿Qué es?
La estequiometría es el cálculo para una ecuación química balanceada que determinará las proporciones entre reactivos y productos en una reacción química.
El balance en la ecuación química obedece a los principios de conservación y los modelos atómicos de Dalton como, por ejemplo, la Ley de conservación de masa que estipula que:
la masa de los reactivos = la masa de los productos
En este sentido, la ecuación debe tener igual peso en ambos lados de la ecuación.
- Cálculos estequiométricos:
Cálculo estequiométrico por tanteo
El método por tanteo para calcular la estequiometría de una ecuación se deben seguir los siguientes pasos:
- Contar la cantidad de átomos de cada elemento químico en la posición de los reactivos (izquierda de la ecuación) y comparar esas cantidades en los elementos posicionados como productos (derecha de la ecuación).
- Balancear los elementos metálicos.
- Balancear los elementos no metálicos.
Por ejemplo, el cálculo estequiométrico con el método por tanteo en la siguiente ecuación química:
CH4 + 2O2 → CO + 2H2O
El carbono está equilibrado porque existe 1 molécula de cada lado de la ecuación. El hidrógeno también presenta las mismas cantidades de cada lado. El oxígeno en cambio, suman 4 del lado izquierdo (reactantes o reactivos) y solo 2, por lo tanto por tanteo se agrega un subíndice 2 para transformar el CO en CO2.
De esta forma, la ecuación química balanceada en este ejercicio resulta: CH4 + 2O2 → CO2 + 2H2O
Los números que anteceden el compuesto, en este caso el 2 de O2 y el 2 para H2O se denominan coeficientes estequiométricos.
Cálculo estequiométrico por método algebraico
Para el cálculo estequiométrico por método algebraico se debe encontrar los coeficientes estequiométricos. Para ello se siguen los pasos:
- Asignar incógnita
- Multiplicar la incógnita por la cantidad de átomos de cada elemento
- Asignar un valor (se aconseja 1 o 2) para despejar el resto de las incógnitas
- Simplificar
- Relaciones Estequiométricas
Las soluciones químicas presentan concentraciones diferentes entre soluto y solvente. El cálculo de las cantidades obedece a los principios de conservación y los modelos atómicos que afectan los procesos químicos.
- Principios de conservación
Los postulados de los principios de conservación ayudarán posteriormente a definir los modelos atómicos sobre la naturaleza de los átomos de John Dalton. Los modelos constituyen la primera teoría con bases científicas, marcando el comienzo de la química moderna.
Ley de conservación de masa: no existe cambios detectables en la masa total durante una reacción química. (1783, Lavoisier)
Ley de las proporciones definidas: los compuestos puros siempre presentan los mismos elementos en la misma proporción de masa. (1799, J. L. Proust)
- Estequiometría y conversión de unidades
La estequiometría usa como factor de conversión desde el mundo microscópico por unidades de moléculas y átomos, por ejemplo, N2 que indica 2 moléculas de N2 y 2 átomos de Nitrógeno hacia el mundo macroscópico por la relación molar entre las cantidades de reactivos y productos expresado en moles.
En este sentido, la molécula de N2 a nivel microscópico tiene una relación molar que se expresa como 6.022 * 1023 (un mol) de moléculas de N2.
Ejemplos:
- Cálculos basados en reacciones químicas:
- Método del mol:
- Volumen molar
Lic. Marroquín Tinti M. N. Catedrática de la Universidad Galileo de Guatemala (2021), presentación "Química General"
Lozano Lucena, J. J.; Rodríguez Rigual, C. (1992). Química 3: estequiometría. Pearson Alhambra. p. 64
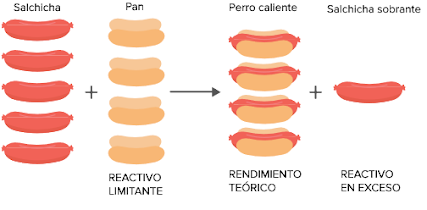
Reactivo limitante y reactivo en exceso
Reactivo limitante: - Cuando se efectúa una reacción, los
reactivos no están presentes en cantidades
estequiométricas necesariamente, es decir,
en las proporciones que indica la ecuación
balanceada.
- El reactivo que se consume primero en una
reacción se denomina reactivo limitante, ya
que la máxima cantidad de producto
depende de la cantidad de este reactivo.
- Cuando el reactivo limitante se
consume no se puede formar
más producto.
- Los reactivos en exceso son los
reactivos presentes en mayor
cantidad que la necesaria para
reaccionar con la cantidad de
reactivo limitante.
- Los reactivos en exceso son los
reactivos presentes en mayor
cantidad que la necesaria para
reaccionar con la cantidad de
reactivo limitante.
- NUNCA LOS CÁLCULOS DEBEN
EFECTUARSE CON LOS REACTIVOS
EN EXCESO.
Ejemplo:
Rendimiento de reacción:- La cantidad de reactivo limitante
determina el RENDIMIENTO
TEÓRICO de una reacción, a través
de la aplicación del método del mol.
- El rendimiento teórico es el
rendimiento máximo que se puede
obtener cuando la reacción es
exitosa en un 100%.
- En la práctica el RENDIMIENTO
REAL es menor que el
rendimiento teórico, a lo sumo
igual pero NUNCA mayor.
- El rendimiento real se determina
sólo a través de experimentos y
es usualmente un dato que los
problemas suelen dar.
¿Por qué el rendimiento real nunca es igual al rendimiento teórico?• Reacciones reversibles • Difícil recuperar todo el
producto • Reacciones laterales• Difícil purificar el producto
Formula para sacar el porcentaje de rendimiento
Ejemplos:
Practiquemos:
- • El titanio se obtiene por la reacción
de cloruro de titanio (IV) con
magnesio a 950
0C y 1150
0C. • Escriba la ecuación balanceada
que representa la reacción.
- • Cuando se calienta el litio, reacciona con el nitrógeno para
formar nitruro de litio.
• Escriba la ecuación balanceada del proceso.
• ¿Cuál es el rendimiento teórico de nitruro de litio en gramos
cuando se hacen reaccionar 12.3g de Li en 33.6g de
nitrógeno?
Creación y realización Thema Equipo Editorial S. A. (2002) Consultor Estudiantil "Mi Secundaria".
- Cuando se efectúa una reacción, los reactivos no están presentes en cantidades estequiométricas necesariamente, es decir, en las proporciones que indica la ecuación balanceada.
- El reactivo que se consume primero en una reacción se denomina reactivo limitante, ya que la máxima cantidad de producto depende de la cantidad de este reactivo.
- Cuando el reactivo limitante se consume no se puede formar más producto.
- Los reactivos en exceso son los reactivos presentes en mayor cantidad que la necesaria para reaccionar con la cantidad de reactivo limitante.
- Los reactivos en exceso son los reactivos presentes en mayor cantidad que la necesaria para reaccionar con la cantidad de reactivo limitante.
- NUNCA LOS CÁLCULOS DEBEN EFECTUARSE CON LOS REACTIVOS EN EXCESO.
- La cantidad de reactivo limitante determina el RENDIMIENTO TEÓRICO de una reacción, a través de la aplicación del método del mol.
- El rendimiento teórico es el rendimiento máximo que se puede obtener cuando la reacción es exitosa en un 100%.
- En la práctica el RENDIMIENTO REAL es menor que el rendimiento teórico, a lo sumo igual pero NUNCA mayor.
- El rendimiento real se determina sólo a través de experimentos y es usualmente un dato que los problemas suelen dar.



No hay comentarios.:
Publicar un comentario